• 水素原子のエネルギー準位E n の特徴は – 主量子数(整数)nの−2乗に比例 – 基底状態はn =1でnが増えるとエネルギーが大 きくなる(絶対値が小さくなる) – nが増えると準位間隔が狭くなり、E =0とE = E 1 の間に無限個の準位が存在 • 主量子数nに対し⑤水電解装置:欧州企業が大型化技術などで先行 ・日本企業は世界最大級の水電解装置を建設するとともに、要素 技術でも世界最高水準の技術を保有。 ・しかし、更なる大型化を目指すための技術開発では、欧州等、他 国企業が先行。水素型原子のエネルギー固有値と固有関数 153 132 水素型原子のエネルギー固有値と固有関数 1321 エネルギー固有値 無次元化したエネルギーλ と主量子数n の関係式(1323) から,λ の定義式(138) を用 いて,エネルギー固有値は E n = − mZ2(αc)2 2n2 (1331) で与え

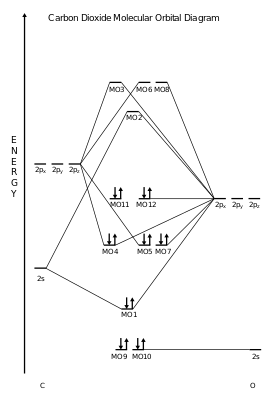
二酸化炭素について 先日 思い入れのある気体ということで二酸化炭素について紹介した 前回は主として状態図から超臨界の話などを書いたが 今回はもう少し 階層を下げて分子レベルでのお話 1985年4月 工学部反応化学科の松為宏幸先生の研究
水 エネルギー準位図
水 エネルギー準位図-ここで Gはギブズエネルギー変化, Hはエンタルピー変 化,T sは可逆的に出入りする熱である.Fig.1に水電解に 必要なエネルギー値を示してある.標準状態(1atm)で考 えると,水1モルと水素1モル,酸素1/2モルのエネルギー軌道エネルギー準位図について解説されている. これらの説明およびテキストp71の図355(下図)を基本と して,以下の問いに答えよ.(実際には,この図とは違う ダイヤグラムも書けるが,テキストで言及しているように, 高度に簡素化した形で考える)



無機化学 大学院の入試問題で 異核二原子分子の分子軌道 エネルギー準 Yahoo 知恵袋
エネルギー準位 を正確に再現 2π h mvr =n プランクの 量子仮説 mv h p h λ= = シュレーディンガー波動方程式 ハイゼンベルクの不確定性原理 運動量と位置の同時測定 の不確定性 Ψ= Ψ Ψ − V E dx d m h 2 2 2 2 8π 4π h ΔxΔp ≥ 黒体放射 ↓ E=hν 光電効果軌道エネルギー(原子単位系) 原子単位系(ハートリー単位系)は とした単位系である 。 これにより物理量を簡単な形で書くことができ、上で見てきたような文字だらけにならなくて済む。 その反面、何の単位を扱っているかわかりにくくなることも <水の蒸発熱のエネルギー図> これは、『液体の水に熱量(42kj)を加えると水蒸気(h 2 oの気体の状態)になった』、 ということを表しており、感覚的にも一致するのではないでしょうか。(コンロで水を熱し続けると、すべて蒸発してしまうイメージです。
電子のエネルギー準位 化学で学んだかもしれませんが、原子は、原子核の周りを 回転する電子で構成されています。 しかし、電子は好きな軌道を選ぶことはできません。 特定のエネルギーをもつ軌道に制限されているのです。 それぞれの軌道がもつ12 4f電子が受ける力 – ハミルトニアンH;運動エネルギー 核電子静電ポテンシャル演算子 電子電子 核核静電 22 2 2 i xy z22 2 ∂∂ ∂ ∇= ∂∂ ∂ 演算子 、ポテンシャル演算子 このハミルトニアン演算子を使った ii i ミルト アン シュレーディンガー方程式は厳密に 解くことはできない!
赤羽賢司, 他19) 分子 遷移 周波数 GHz A s1 臨界密度道のエネルギー差に相当するエネルギーの光量子しか吸収することができない.図33 に h2o 分子の分子軌道のエネルギー準位を示す.丸で示したのが電子であり,各準位に2 個ずつ,エネルギーの低い準位からつまっていく.例えば,準位4 にある電子は波長62従って,あるエネルギーeがあったときに, e/2のエネルギーが必要な振動を2個分励起する のに比べ, e/3のエネルギーが必要な振動を3個分励起する のは非常に困難(=そのような失活が起こりにくい).



2
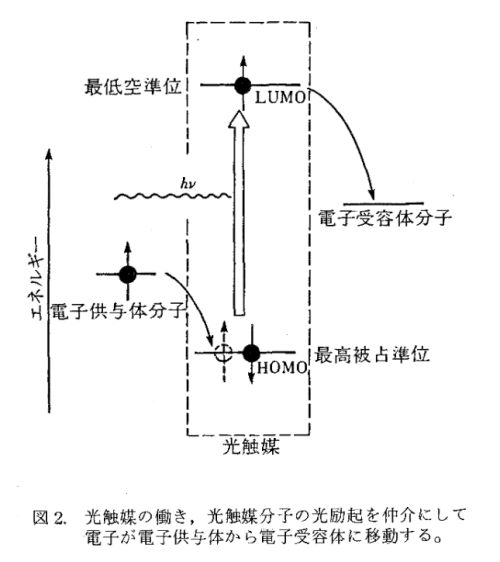



光合成の再勉強 その8 鈴木頌の発言 国際政治 歴史 思想 医療 音楽
原子は、その原子に特有ないくつかのエネルギー状態(エネルギー準位)をもっています。 エネルギーの低いものから、第1励起状態、第2励起状態(n =1, 2, )と名づけられています。 原子内の電子は、光を吸収することによってエネルギーを手に入れこれらの軌道のエネルギー準位は、以下の図のようになっています。 アミドは一般的にカルボン酸とアミンから水がとれてできる化合物であり、官能基としてはR1CONHR2という形で表されます。アミドはカルボン酸の語尾oic acidをアミド(amide)に変えて命名真空準位 (しんくうじゅんい、 英 vacuum level )は、内部に構造を持たない電荷を持った粒子( 荷電粒子 )が、真空中に孤立(かつ単独)で存在し、加えて 運動エネルギー がゼロの状態にある時の最低の エネルギー準位 のこと。




レーザー誘起蛍光法によるohラジカル密度計測 技術資料 岩崎電気



2
化された。nで決まる固有エネルギーE n のことをエネルギー準位と呼ぶ。水素原子のエネルギー 準位の特徴は(図2参照) • 主量子数(整数)nの−2乗に比例 • 基底状態はn =1でnが増えるとエネルギーが大きい励起状態をあらわす(絶対値が小さく なる)水素をエネルギーとして利用するには、エンジンなどで燃焼させる方法や、燃料電池を用いて電気を取り出す方法があります。 いずれの場合でも水素は、利用段階においてはCO 2 を排出しないクリーンなエネルギーですが、燃料電池のほうがエネルギー変換530 座標系変換(*) 617 水素原子の電子エネルギー準位;




分子軌道ダイアグラム Wikiwand



2
ななるるなる 。この電子が取り得るエネルギー 値を「エネルギー 準準位位準位 energy level 」という 。一番低いエネ ルギー 準位はn =1のときで 4 1 2 2 0 1358 8 mq E εh =− ≅− eV である 。この準位は「基底準位 ground state 」といい 、一番安定した準位である 。 解決済 大学でもらったプリントで水のMOは下表のようになってました。 ・1S軌道のσ結合から水のMOのエネルギーがもっとも高い箇所、一番低い箇所、三番低い箇所に点線でつながっている。 この本は、2P軌道とHのσ*結合の関係は書いてあるけど、2P軌道 ゼーマン効果 例えば水素原子が外部磁場にさらされて1s状態から2p状態になるとしましょう。 このとき各量子数の変化は、 になります。 したがって、取りうるエネルギー状態が1種類から3種類に変化します。 このような外部磁場によるエネルジー準位の



均一と考えられていた液体の水に不均一な微細構造を発見 透明な水に隠された謎を日米の放射光の観察で解明 プレスリリース Spring 8 Web Site



2
けその1において電子エネルギー準位と電極電位との関 連について記し,次号のその2で励起種の電極反応・特 に光によって励起状態が生成される場合を扱う,いわゆ る光電極反応について述べることとする. 2有機化合物の電子エネルギー準位と 酸化還元電位化学 水のmoのエネルギー準位の表記について 大学でもらったプリントで水のmoは下表のようになってました。 エネルギーが高い側 -(空) -(空) 質問no22 回転エネルギーの準位 分子の回転運動は量子化されている 1 古典論の回転運動のエネルギーを角運動量で表す 2 角運動量を量子化する r a m ω a 回転運動のエネルギーは rad s1 (= m r a 2) (前回の授業から)
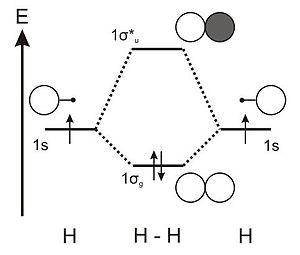



分子軌道ダイアグラム Wikipedia
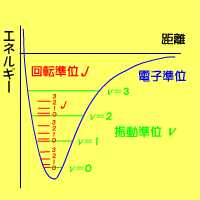



Radio Line
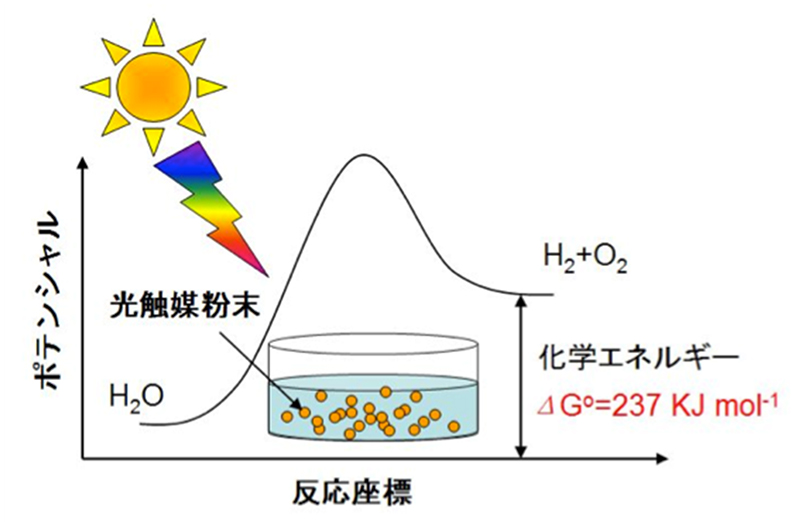
例の場合は,気体15mol( mL)が水1mol(18mL)になるの で,ΔS° < 0,ΔG°=kJΔG°が,化学変化で利用できるエネルギー である(これが,物質本来のエネルギーである。宣伝に出てくる 「水本来のエネルギー」などという言い方は変で,物質として水でと求められる。ここでも、n は整数であるので、電子のエネルギーはとびとび(不連続)な値になる。 この電子が取り得るエネルギー値を「エネルギー準位energy level」という。一番低いエネルギー 準位はn =1のときで 4 1 22 0 1358 8 mq E εh =− ≅− eV である。物質同士の接合、接触によって特徴的な様相を示す。 その一つに『触媒』の不思議も挙げられよう。 『エネルギー準位』とは必ずしもその物質の保有するエネルギーと断定できなかろう。 その物質がその外部空間に存在する物質に対して影響する空間へ



2
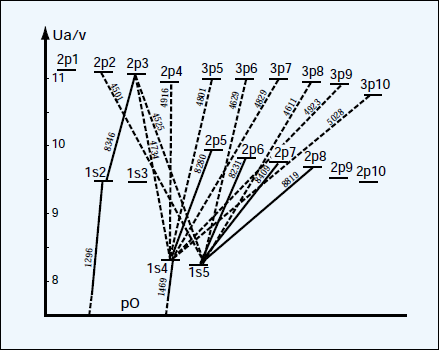



各ランプの基礎知識 ウシオ技術情報誌 ライトエッジ ウシオ電機
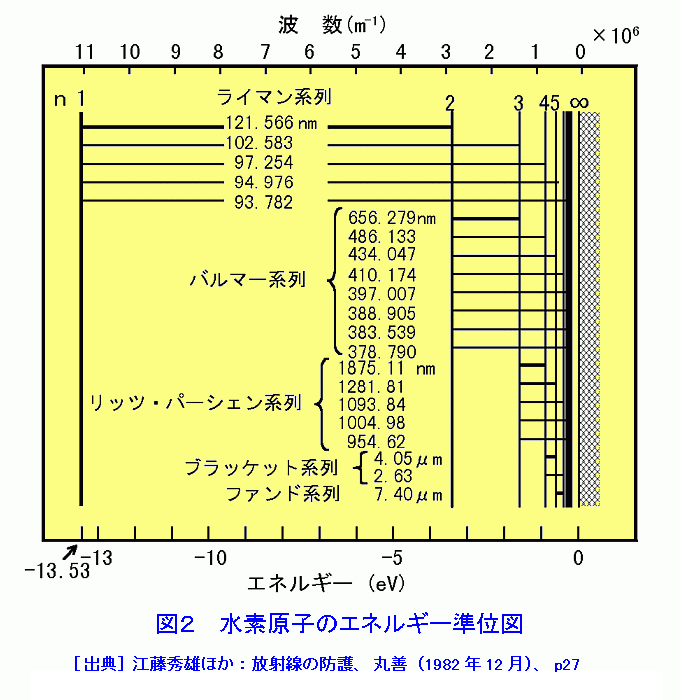
水素原子のエネルギー準位図 本図表を掲載しているATOMICAデータを参照するには下記をクリックして下さい。 水素原子のエネルギー準位図 (02) JAEAトップページへ ATOMICAトップページへG.エネルギー準位・原子スペクトル・並進運動・Zeeman Effect エネルギー準位 エネルギー式を求めます。 再掲 式(E6)と式(E12)より次のようになります。 中辺と右辺を2乗します。 これに式(E5)を代入すると次のようになります。 Eは、次のように得られます。5 電子遷移 SmYAGのエネルギー準位 1 4f電子が受ける力 11 ランタニドの4f電子軌道;



分子軌道ダイアグラム Wikipedia



2



原子のエネルギー準位



原子のエネルギー準位




朗報 やっと高校化学で原子軌道 S軌道 P軌道 D軌道 を学び あれらの疑問がスッキリ説明可能に 友野和哲 研究室



混成軌道



新しい原子構造 ベリリウム ホウ素 炭素



分子振動はなぜ起こるの エネルギー 電磁波との関係は 赤外分光



2



化学 水素 酸素の分子軌道 技術情報館 Sekigin 水素分子 及び酸素分子の分子軌道について エネルギー 順位と電子配置を具体的に紹介するとともに 分子軌道と結合次数の考え方も紹介




分子軌道ダイアグラム Wikipedia



研究内容 工藤研究室 光触媒研究グループ 東京理科大学理学部第一部 応用化学科



酸素と酸化チタン



2



Vuv Uv光の発生方法とその応用 ウシオ技術情報誌 ライトエッジ ウシオ電機




仕事関数
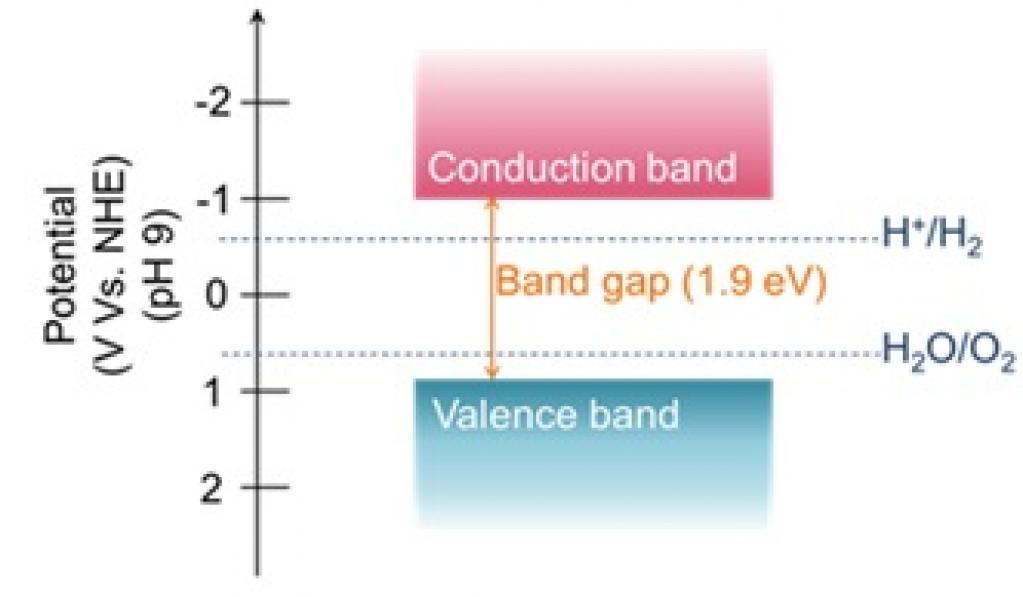



Nedo 世界初 可視光を利用して水を分解する酸硫化物光触媒を開発 Motor Fan モーターファン ギャラリー




混成軌道に対する勘違いに今更気付いた話 思考のお道具箱




分子軌道ダイアグラム Wikiwand




二酸化炭素について 先日 思い入れのある気体ということで二酸化炭素について紹介した 前回は主として状態図から超臨界の話などを書いたが 今回はもう少し 階層を下げて分子レベルでのお話 1985年4月 工学部反応化学科の松為宏幸先生の研究



2




二酸化炭素について 先日 思い入れのある気体ということで二酸化炭素について紹介した 前回は主として状態図から超臨界の話などを書いたが 今回はもう少し 階層を下げて分子レベルでのお話 1985年4月 工学部反応化学科の松為宏幸先生の研究




分子軌道ダイアグラム Wikipedia




エントロピーとエンタルピーの弁証法 バックアップ



2



2



2




酸素分子o2




金および銀ナノ粒子を用いた表面増強型太陽エネルギー変換システム




第103回薬剤師国家試験 問100 Yakugaku Lab




ファイル Diagramme Ah2 Png Wikipedia
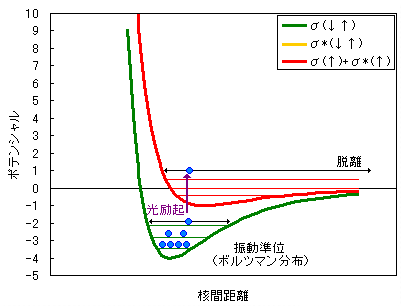



Esco 電子科学株式会社



2



2



共同発表 水素の大量製造を可能にする光触媒の理論設計に成功 太陽光を利用して水から水素を取り出す技術の促進に期待



2



質問箱



書籍紹介 図説 量子化学 大野公一 山門英雄 岸本直樹 共著 化学




二酸化炭素について 先日 思い入れのある気体ということで二酸化炭素について紹介した 前回は主として状態図から超臨界の話などを書いたが 今回はもう少し 階層を下げて分子レベルでのお話 1985年4月 工学部反応化学科の松為宏幸先生の研究
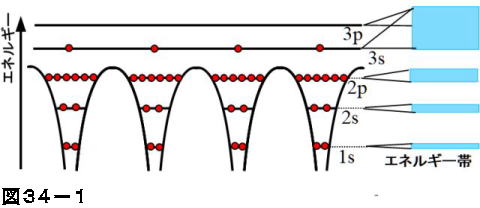



半導体物理学



化学魔の還元 熱化学編 6 エネルギー準位図 公式




最先端の機能を支える光化学反応 クリーンエネルギーをもたらす光触媒作用 テクの雑学 Tdk Techno Magazine




Q A




メタン分子ch4



2
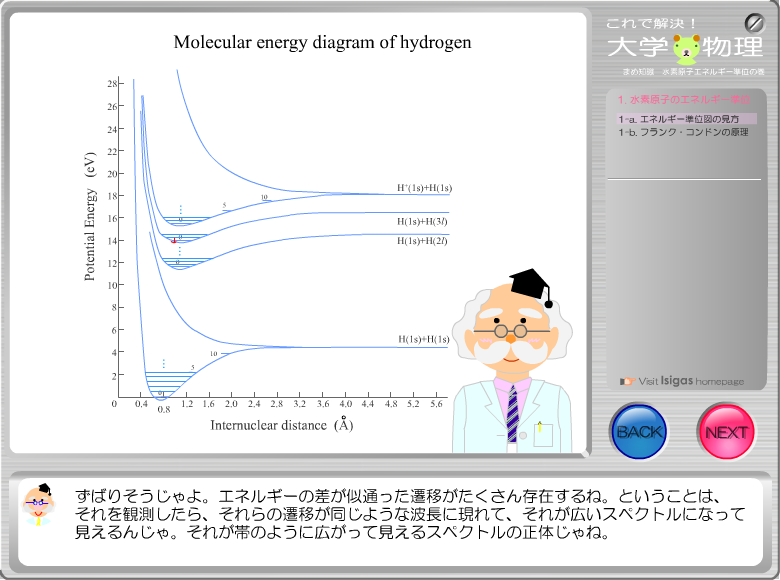



これで解決 シリーズ 大学物理 水素原子スペクトル



Co回転スペクトル おっさんの備考録



トップpdf 電子のエネルギー準位の幅 123deta Jp



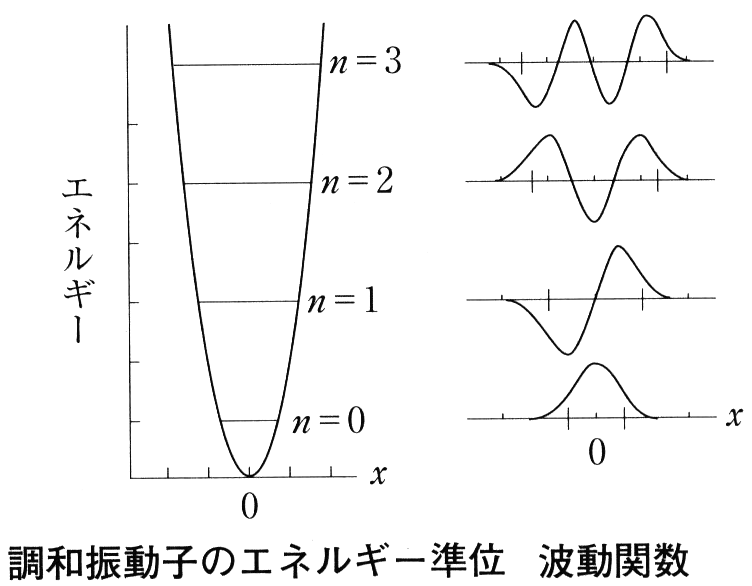
3



1
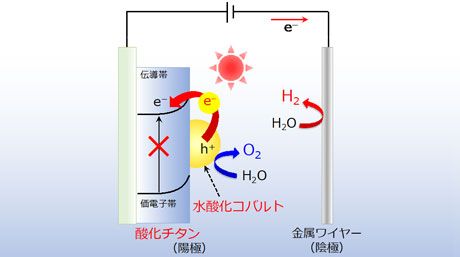



新しい原理で駆動する可視光水分解電極を開発 ありふれた物質に眠る有用な新機能を発見 東工大ニュース 東京工業大学
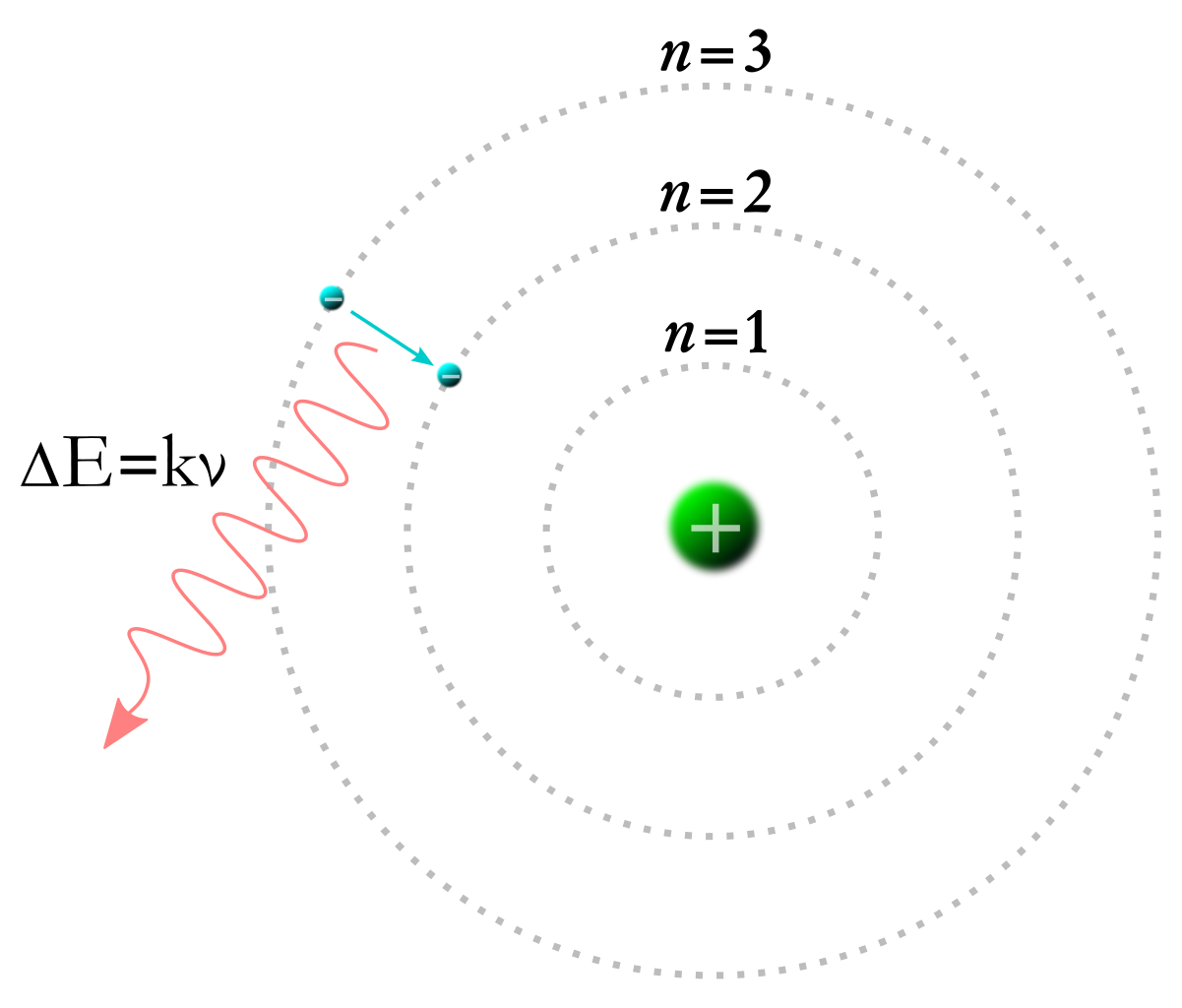



原子物理 4 水素原子の構造とイオン化エネルギー高校化学と物理の融合
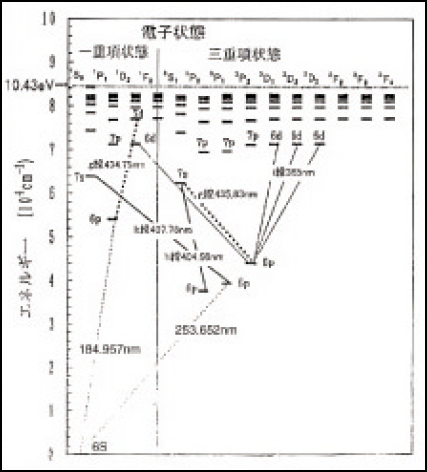



超高圧水銀ランプ ウシオ技術情報誌 ライトエッジ ウシオ電機



原子がイオン化されて s軌道から電子を一つ失うとき s軌道のほうがd軌道より位置エネルギーは低いのですから なぜd軌道からs軌道に電子が移動しいないのですか Quora



1



原子のエネルギー準位



軌道エネルギー準位初めまして Co分子の軌道エネルギー準位についての質問 Yahoo 知恵袋




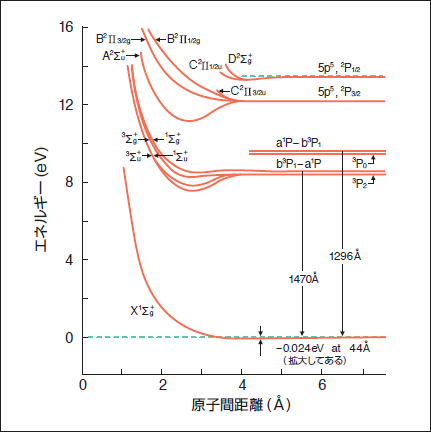
Oh 天文学辞典



画像は一酸化炭素coの分子軌道のエネルギー準位であるが Homo 最高被占軌 Yahoo 知恵袋



放射線の電離作用 08 01 02 02 Atomica
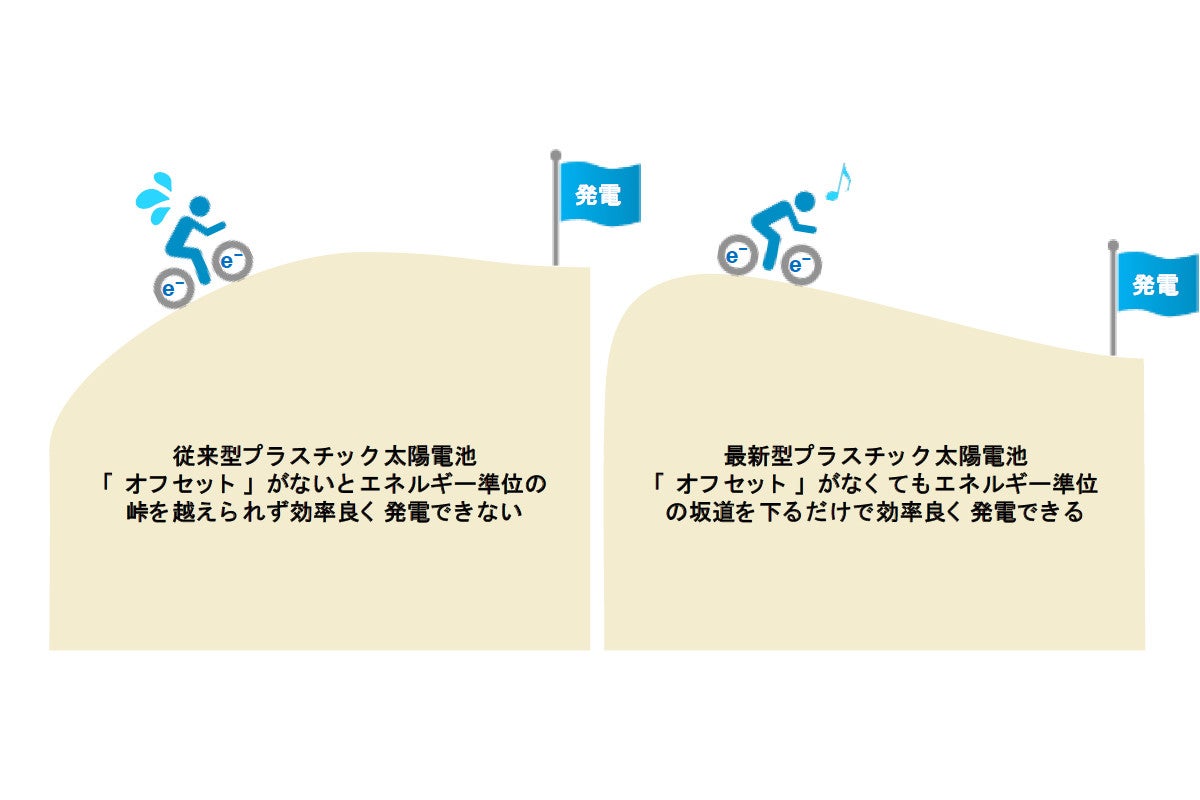



京大など Nfaを用いた有機薄膜太陽電池の発電機構を解明 Tech
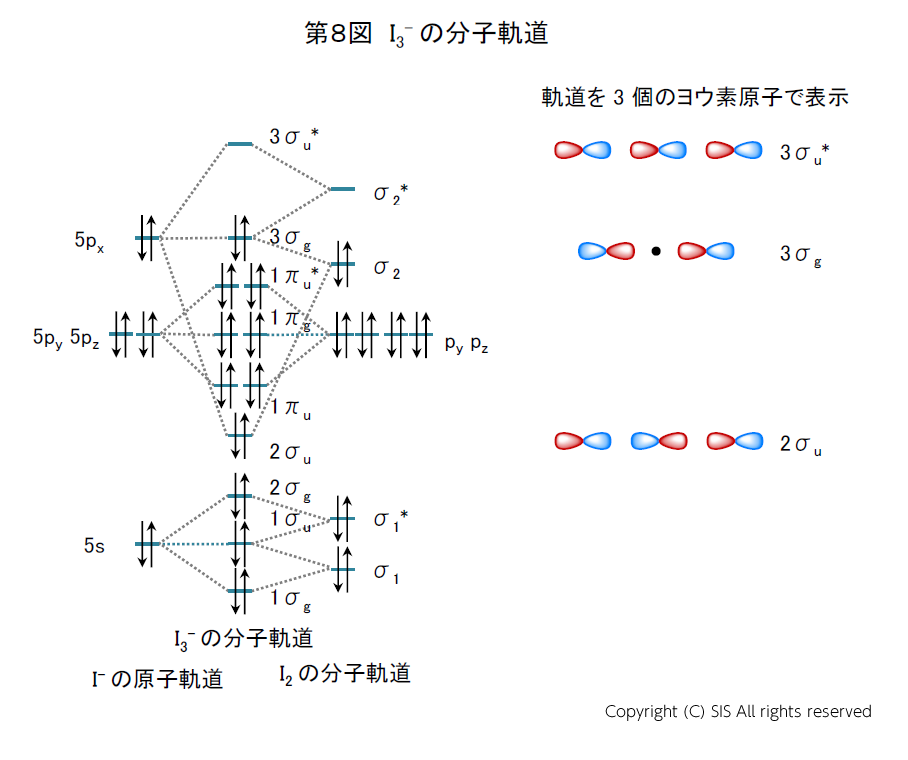



ヨウ素とは ヨウ素学会
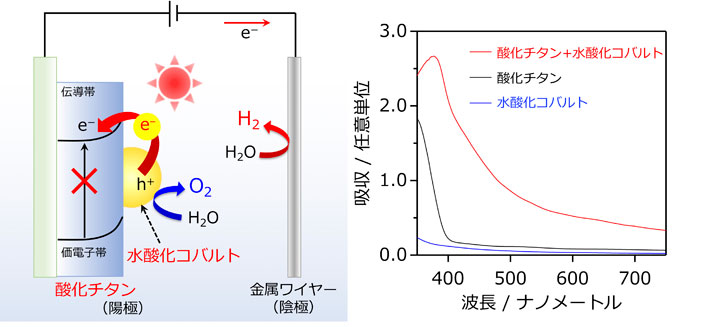



新しい原理で駆動する可視光水分解電極を開発 ありふれた物質に眠る有用な新機能を発見 東工大ニュース 東京工業大学



二原子分子のエネルギー準位図について 添付した図に関して質問がありま Yahoo 知恵袋
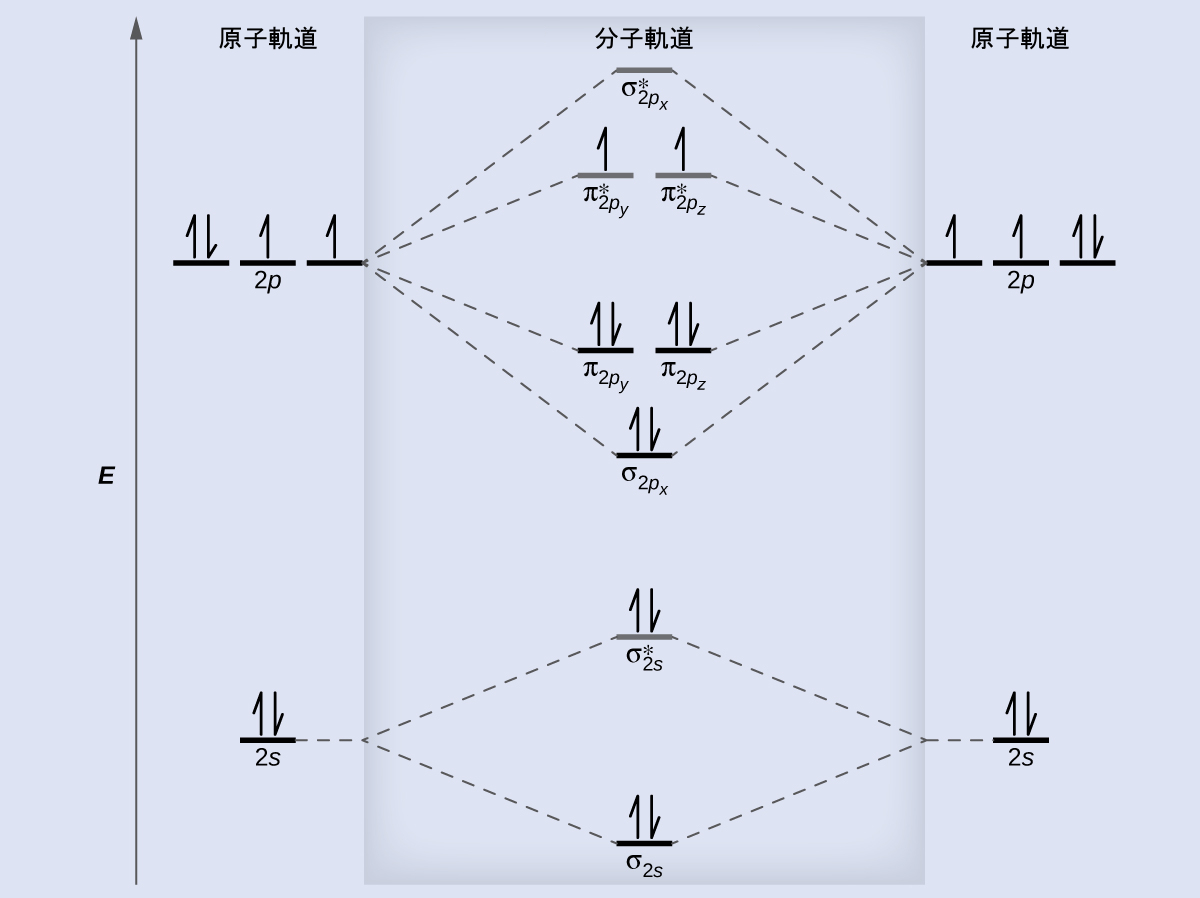



第8章 共有結合の高度な理論 化学 第2版



2



半導体 電子デバイス物理



化学魔の還元 熱化学編 6 エネルギー準位図 公式




分子軌道ダイアグラム Wikipedia
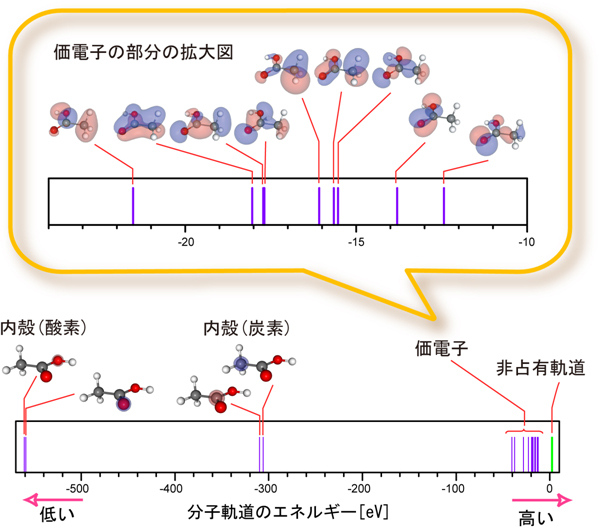



溶液中の分子軌道の形を判別する観測に世界で初めて成功 理化学研究所




高校物理 ボーアの理論 その4 エネルギー準位とリュードベリ定数 Youtube
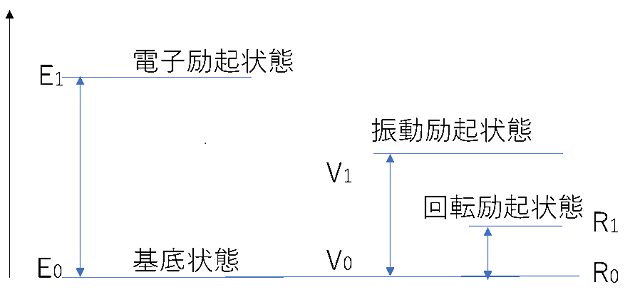



分子振動はなぜ起こるの エネルギー 電磁波との関係は 赤外分光



2
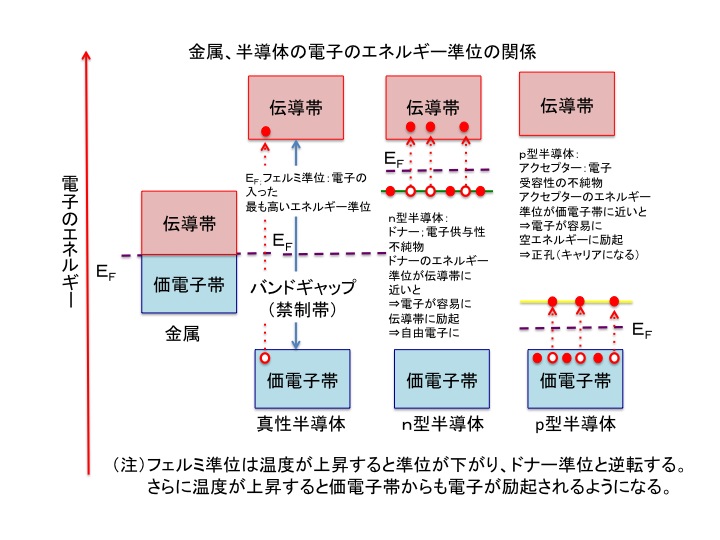



調べもの 導体 半導体のエネルギー準位 あべ野きのこ日記




メタン分子ch4
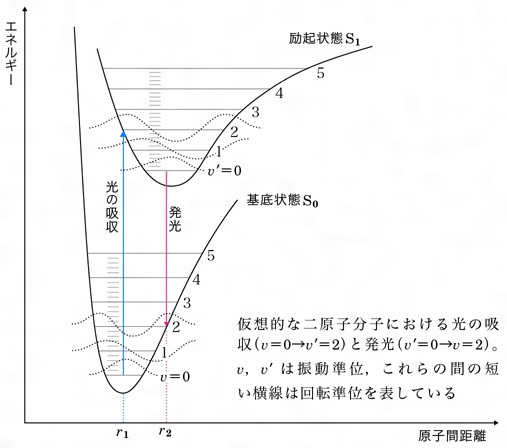



蛍光性色素とは コトバンク
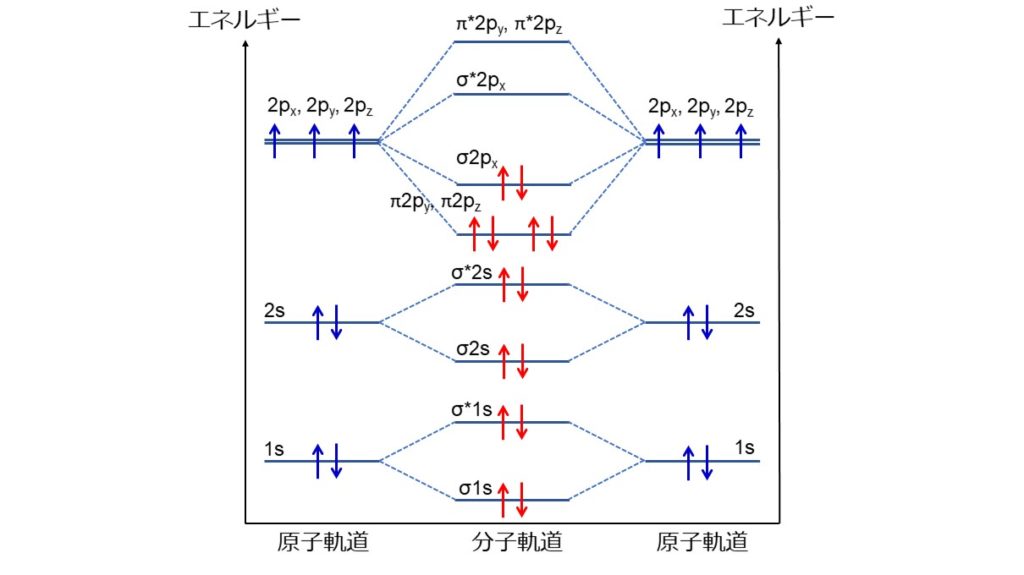



窒素分子はなぜ三重結合をつくるのか ジグザグ科学 Com



化学 水素 酸素の分子軌道 技術情報館 Sekigin 水素分子 及び酸素分子の分子軌道について エネルギー 順位と電子配置を具体的に紹介するとともに 分子軌道と結合次数の考え方も紹介




分子軌道ダイアグラム Wikipedia
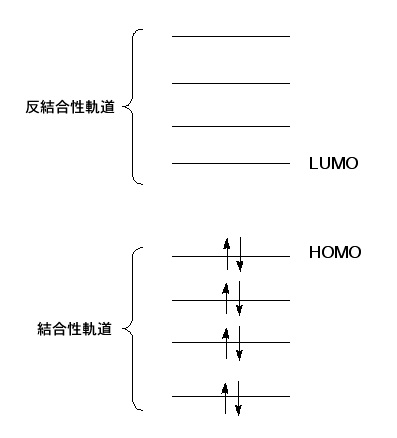



Homoとlumo




混成軌道に対する勘違いに今更気付いた話 思考のお道具箱



2



2



2



2



2



無機化学 大学院の入試問題で 異核二原子分子の分子軌道 エネルギー準 Yahoo 知恵袋



2




分子軌道法のエネルギー準位 電子配置のエネルギー準位は低い方から1s 化学 教えて Goo



化学についてで酸素のエネルギー準位図は写真であってますか 合ってると Yahoo 知恵袋



3




Q A



0 件のコメント:
コメントを投稿